2025年2月5日,西湖大學醫學院董晨團隊在Journal of Experimental Medicine上發表了題為“Regulatory T cells converted from T helper 1 cells in tumors suppress cancer immunity via CD39”的研究論文。該研究深入解析了腫瘤內調節性(Treg)細胞的發育路徑与功能特性,揭示了T-bet+ Treg細胞在腫瘤免疫中的關鍵作用,發現這些細胞通過高表達CD39抑制CD8 T細胞的功能,并提出了通過靶向T-bet+Treg細胞來增強抗腫瘤免疫反應的潛在策略,為癌症免疫治療開辟了新的方向。
文章鏈接:
https://doi.org/10.1084/jem.20240445
盡管調節性T(Treg)細胞在維持免疫耐受性中至關重要,但在腫瘤微環境中,它們的免疫抑制作用使腫瘤細胞能夠逃脫免疫系統的監視,這使得研究腫瘤內Treg細胞的作用變得尤為關鍵。近年來,腫瘤微環境被發現能夠促進Treg細胞的招募和發育,這一過程對腫瘤免疫逃逸至關重要。大量研究發現,腫瘤浸潤的Treg細胞在許多癌症中顯著增多,并且Treg細胞与CD8+ T細胞的比例升高往往与癌症患者的不良預后相關。盡管如此,腫瘤微環境中Treg細胞的功能及其來源仍缺乏系統的研究。
腫瘤浸潤的Treg細胞被認為是癌症免疫治療的潛在治療靶標。然而,系統性去除Treg細胞可能引發自体免疫反應。靶向Treg細胞上恒定表達的分子可能導致自体免疫副作用。因此,識別并選擇性地靶向腫瘤微環境中主要的Treg細胞亞群至關重要。
根据來源,Treg細胞可分為兩种亞群,即胸腺來源的天然Treg(tTreg)細胞和外周誘導的Treg(pTreg)細胞。tTreg細胞在胸腺內通過T細胞受体(TCR)与自我_/主要組織相容性复合体(MHC)之間的高親和力相互作用篩選生成。而pTreg細胞則是從常規CD4+ T細胞在TCR刺激和轉化生長因子(TGF)-β及白介素(IL)-2的作用下在外周產生的。FOXP3轉錄因子是這兩种Treg細胞的標志,并且對它們在胸腺和外周的細胞譜系承諾或分化至關重要。有研究表明,神經元蛋白1(NRP1)可能作為tTreg細胞的特异性標志。盡管Treg細胞在腫瘤微環境中的積累已被長期報道,但腫瘤浸潤Treg細胞的來源依然是一個存在爭議并亟待解答的研究問題。
在應對環境信號時,Treg細胞可能表現出可塑性,并表現出類似于CD4+輔助T細胞的表型。最早在感染結核分枝杆菌的實驗鼠中發現,T-bet+ Treg細胞在炎症部位積累,抑制Th1介導的炎症反應。類似地,在單核細胞增生李斯特氏菌感染的實驗鼠中,T-bet+ Treg細胞在次級淋巴器官中富集,抑制Th1型炎症反應。此外,T-bet+ Treg細胞還在人的咽喉癌、非小細胞肺癌(NSCLC)及小鼠肺腫瘤模型的腫瘤微環境中被發現,同時在炎症性腸病(IBD)和葡萄糖_酸鹽(DSS)誘導的結腸炎模型患者的腸道中也有類似現象。然而,T-bet+ Treg細胞在癌症中的發育過程和功能仍缺乏深入研究。
腫瘤微環境中pTreg細胞的積累
該研究對多种小鼠腫瘤模型中的Treg細胞亞群進行了分析。研究人員使用NRP1作為標記,區分了胸腺來源的tTreg細胞和外周誘導的pTreg細胞。研究發現,在淋巴結和脾臟中,大部分Treg細胞為NRP1+(即tTreg細胞),但在腫瘤中,超過一半的Treg細胞為NRP1-(即pTreg細胞)。通過過繼轉移實驗,進一步驗證了這一結果。實驗表明,腫瘤中的Treg細胞約有50%是pTreg細胞,這些細胞來源于常規CD4+ T細胞。相比之下,淋巴結和脾臟中的Treg細胞主要為tTreg細胞。研究表明,腫瘤微環境可能通過促進pTreg細胞的積累,導致免疫抑制。
pTreg細胞在促進腫瘤生長中的重要作用
該研究接著探討pTreg細胞在腫瘤免疫中的作用。研究人員通過過繼轉移方法選擇性去除pTreg細胞,利用Foxp3DTR小鼠和白喉毒素(DT)去除pTreg細胞,而不影響tTreg細胞,從而避免自身免疫反應。結果表明,去除pTreg細胞后,腫瘤生長被抑制。与此同時,腫瘤浸潤性CD8+ T細胞數量增加,并表現出更強的增殖能力和溶細胞活性。此外,腫瘤微環境中的髓系細胞群体比例發生變化,TAMs和單核細胞減少,中性粒細胞增多。進一步的治療評估發現,在E.G7腫瘤模型的晚期去除pTreg細胞后,腫瘤生長得到抑制,CD8+ T細胞比例增加,且腫瘤浸潤的CD8+ T細胞在總活細胞中的比例上升,特別是IFN-γ、顆粒脢B和CD107a的細胞比例。總体而言,去除pTreg細胞對荷瘤小鼠產生了有效的治療效果。
腫瘤內Treg細胞高度表達T-bet轉錄因子
接著,該研究分析了腫瘤內Treg細胞是否在基因表達上与任何Th亞群相似,通過RNA測序對來源于Hepa1-6和E.G7小鼠腫瘤模型的腫瘤內Treg細胞進行轉錄組分析。結果表明,腫瘤內Treg細胞表現出Th1特征基因(如Tbx21和Ccr5)的上調,而Th2和Th17基因(如Gata3、Rorc和Ccr6)則下調。此外,腫瘤內Treg細胞的Nrp1表達低于淋巴結中的Treg細胞。進一步的流式細胞術分析顯示,腫瘤內Treg細胞高度表達T-bet,但不表達RORγ t、BCL6或GATA3。T-bet+NRP1- Treg細胞占腫瘤內Treg細胞的60%。總体而言,研究結果表明,T-bet+NRP1- Treg細胞是多個癌症模型中腫瘤內Treg細胞的主要群体。
腫瘤內T-bet+ pTreg細胞表現出增強的激活、增殖和抑制功能
進一步研究發現,腫瘤內的pTreg細胞与tTreg細胞相比,表現出更高水平的Th1相關基因上調。同時,pTreg細胞還表現出与Treg細胞抑制功能相關的基因上調,以及与激活、細胞周期調控和趨化因子受体相關的基因上調。研究人員還比較了腫瘤內pTreg細胞与腸道Treg細胞的基因表達特征,發現腫瘤內的pTreg細胞与腸道Treg細胞具有相似的基因表達譜,尤其是在非淋巴組織區域,如含有較高比例pTreg細胞的固有層中。這些結果表明,腫瘤內的T-bet+ pTreg細胞具有增強的激活、增殖和抑制功能,進一步強調了T-bet+ pTreg細胞在腫瘤微環境中的重要作用。
T-bet對腫瘤內pTreg細胞的功能至關重要
該研究接著探討了T-bet在腫瘤內pTreg細胞功能中的作用。通過生成特异性敲除Tbx21的Foxp3YFP-cre Tbx21fl/fl小鼠(KO組),并与 野生型小鼠(WT組)進行對比,發現KO組腫瘤生長明顯減緩,且腫瘤內Treg細胞數量顯著減少。流式細胞術分析顯示,T-bet缺失后,腫瘤內的增殖性Treg細胞減少,CD8+ T細胞的激活和增殖提升,且腫瘤內CD8+ T細胞与Treg細胞的比例增高。進一步的過繼轉移實驗驗證了T-bet在pTreg細胞功能中的關鍵作用。此外,將抗PD-1治療与Treg細胞特异性敲除Tbx21聯合使用,顯著抑制了腫瘤生長,并延長了小鼠的生存期。總的來說,研究表明T-bet在腫瘤微環境中對pTreg細胞的功能至關重要,且其与抗PD-1 治療聯合應用具有潛在的治療效果。
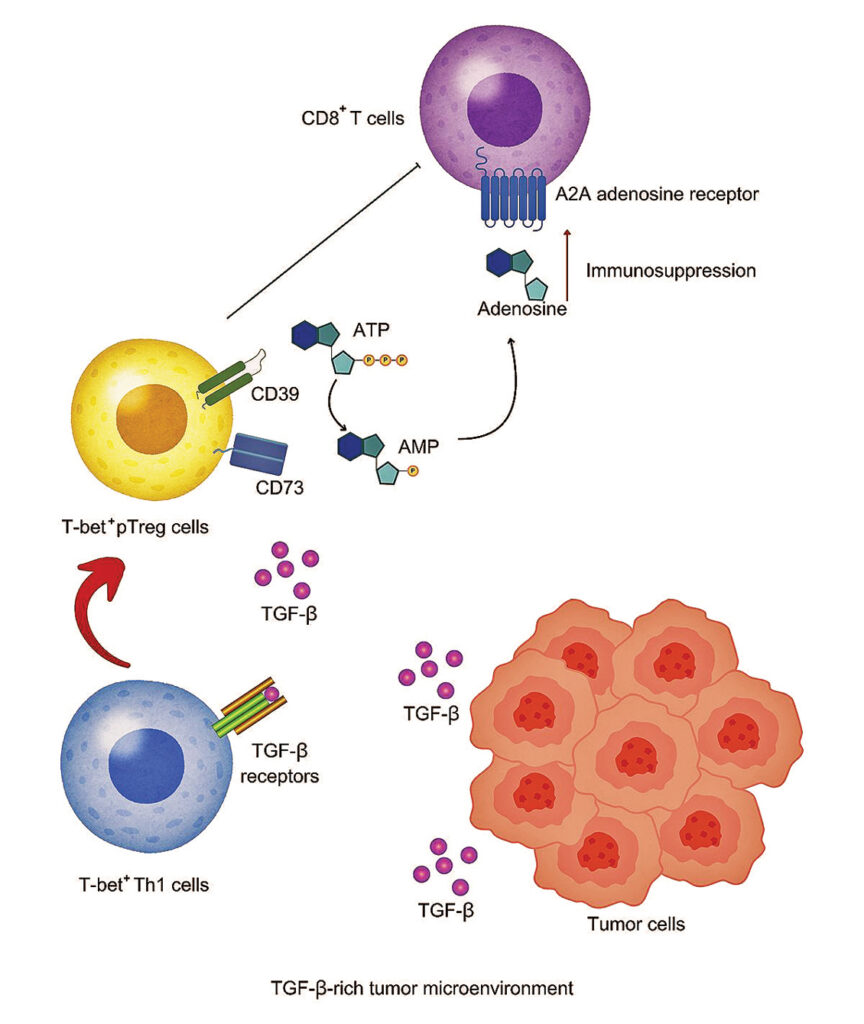
Th1細胞通過TGF-β信號在腫瘤中轉化為pTreg細胞
該研究進一步探討了T-bet+ Treg細胞在腫瘤微環境中的來源和分化路徑。研究人員使用IFN-γ命運映射小鼠腫瘤模型,并結合過繼轉移實驗,揭示了Th1細胞在腫瘤中可轉化為pTreg細胞。實驗中使用TGF-β受体缺失小鼠,發現阻斷TGF-β信號可抑制這一轉化過程,同時抑制腫瘤生長。綜上所述,研究表明,Th1細胞通過響應TGF-β信號通路在腫瘤微環境中轉化為pTreg細胞。
腫瘤內的Tbet+ Treg細胞表現出抑制性促腫瘤特征
接著,研究人員通過單細胞轉錄組分析,進一步闡明了腫瘤內T-bet+ Treg細胞的發育過程及T-bet在該Treg細胞群体中的作用。研究使用Foxp3YFP-cre和Foxp3YFP-cre Tbx21fl/fl小鼠,并將其与常規CD4+ T細胞及無腫瘤淋巴結Treg細胞進行比較。基于基因表達數据,研究識別出五個不同的Treg細胞簇,分別代表不同的Treg細胞階段或類型。其中,Th1樣Treg細胞是最具主導地位的簇,占腫瘤內Treg細胞的至少70%。研究結果表明,Tbx21基因敲除導致Th1樣Treg細胞減少,這一變化与抑制分子下調及Treg細胞功能喪失相關。進一步分析顯示,T-bet缺失削弱了Treg細胞的抑制功能,尤其是CD39介導的代謝干扰功能。偽時間分析進一步證實,Th1樣Treg細胞主要源自腫瘤內的Th1細胞和增殖性Treg細胞,表明TME中的Th1樣Treg細胞是由Th1細胞轉化為pTreg細胞。研究強調T-bet在維持Treg細胞抑制性及促腫瘤功能中的關鍵作用,并為腫瘤免疫治療策略的開發提供了新的思路。
腫瘤內T-bet+ pTreg細胞高度表達CD39
該研究接著通過單細胞轉錄組學和流式細胞術,揭示了CD39在腫瘤內T-bet+ pTreg細胞中的特异性表達,并确定了CD39介導的免疫抑制作用是腫瘤內Th1樣Treg細胞獨特的机制。研究發現,Treg細胞在腫瘤中高度表達CD39,并与嘌呤代謝相關,暗示其在免疫抑制中的關鍵作用。CD39与CD73的共表達在腫瘤內Treg細胞中尤為突出,進一步表明T-bet+ pTreg細胞具有獨特的免疫抑制標志。此外,CD39的表達也在其他含有pTreg細胞高比例的組織中發現,如小腸和結腸的固有層。研究結果提示,CD39可以作為選擇性調節T-bet+ pTreg細胞的潛在治療靶點,為癌症免疫治療提供了新的策略。
癌症患者腫瘤中的Treg細胞顯著共表達T-bet和CD39
接下來,該研究進一步驗證了核苷酸代謝是否為腫瘤內Treg細胞在人体癌症中發揮免疫抑制功能的重要机制。通過分析人類乳腺癌組織的RNA測序數据,研究發現腫瘤內Treg細胞的差异表達基因与小鼠腫瘤模型相似,尤其涉及核苷酸代謝相關的通路。此外,研究還發現,ENTPD1基因(編碼CD39)在多种癌症類型的腫瘤內Treg細胞中普遍上調。通過多种人類癌症的單細胞RNA測序數据,進一步證實了TBX21(編碼T-bet)与ENTPD1在多种癌症類型(如鼻咽癌、乳腺癌、黑色素瘤、鱗狀細胞癌、肝細胞癌和結直腸癌)的腫瘤內Treg細胞中特异性共表達。流式細胞術分析也驗證了肝癌患者樣本中腫瘤內Treg細胞高度共表達T-bet和CD39。這些結果表明,T-bet和CD39的共表達是一种跨越多种人類癌症的免疫抑制机制,与小鼠腫瘤模型的發現相一致。這一新發現為開發針對腫瘤內T-bet+ pTreg細胞的靶向治療提供了理論基礎,有望克服癌症中的免疫抑制。
靶向CD39能夠激發抗腫瘤反應并增強抗PD-1治療效果
接下來,該研究探討了CD39在腫瘤內Treg細胞中的作用及其作為靶點增強抗腫瘤反應的潛力。研究通過創建Foxp3YFP-cre Entpd1fl/fl小鼠,特异性敲除Treg細胞中的Entpd1基因,發現小鼠在缺失CD39后沒有出現自身免疫病理反應或免疫穩態變化。体外實驗顯示,缺乏CD39表達的Treg細胞對CD8+ T細胞的抑制能力顯著下降。体內研究表明,敲除Entpd1后腫瘤生長減緩,且CD8+ T細胞的活性增強。此外,將Treg細胞特异性敲除Entpd1与抗PD-1治療聯合使用,顯著增強了腫瘤抑制效果并提高小鼠存活率。研究結果表明,靶向腫瘤內Treg細胞中的CD39不僅能激發抗腫瘤反應,還能与抗PD-1治療產生協同效應。
綜上所述,該研究探討了腫瘤微環境中Treg細胞的起源、功能及其免疫抑制机制,重點分析了T-bet+ pTreg細胞在腫瘤免疫中的關鍵作用。研究發現,這些Treg細胞主要來源于Th1細胞在TGF-β信號作用下轉化,并通過CD39介導的代謝干扰抑制CD8+ T細胞功能。靶向CD39能夠選擇性地抑制T-bet+ pTreg細胞的免疫抑制作用,而不影響免疫穩態。該研究為癌症免疫治療提供了新的策略,有望在不引發自身免疫反應的情況下增強抗腫瘤免疫反應,推動精准免疫治療的進展,預示著癌症免疫治療的新突破。

編按:西湖大學助理研究員、前清華大學醫學院博士后Sang-Nee Tan為該論文的第一作者,西湖大學醫學院董晨院士為該論文的通訊作者。其他參与人員包括清華大學醫學院、上海免疫治療創新研究院、上海交通大學藥學院和中日友好醫院肝膽外科的成員。該研究得到了中國博士后科學基金、清華北大生命科學聯合中心博士后基金、國家自然科學基金、浙江省自然科學基金、上海本土高水平大學創新研究團隊以及國家重點研發項目等多個項目的支持。

西湖大學醫學院以培養頂尖醫師科學家(Phhysician scientists)為目標。致力予醫學創新和臨床轉化﹐重點聚集微生物學與疫苗﹑免疫學與炎症﹑生理學與代謝﹑腫瘤生物學與治療﹑醫學遺傳與罕見病﹑藥物研發﹑公共健康等研究領域。
 砂麼東東
砂麼東東


